Vắc xin Thương hàn Vi polysaccharide của Việt Nam do DAVAC sản xuất và được cấp phép lưu hành từ 2003, cung cấp cho Chương trình Tiêm chủng Mở rộng Quốc gia nhiều năm qua, dựa trên KN Vi polysaccharide (ViPS) được sản xuất và tinh chế từ chủng Salmonella typhi Ty2, sử dụng một liều duy nhất chứa 25 μg KN ViPS, tiêm dưới da hoặc bắp thịt. Vắc xin ViPS dung nạp tốt và cho hiệu quả bảo vệ trong 3 năm đối với người từ 2 tuổi trở lên. Tuy nhiên, vắc xin ViPS có những hạn chế về cơ chế tạo miễn dịch, dẫn đến hiệu quả bảo vệ kém với trẻ em dưới 2 tuổi, người già trên 60 tuổi và không có khả năng bảo vệ với trẻ em từ 6 -18 tháng tuổi. Nguyên nhân này là do cơ chế đáp ứng miễn dịch của KN ViPS phụ thuộc tế bào lympho B, do đó không tạo trí nhớ miễn dịch và hệ miễn dịch của trẻ em 6 – 18 tháng tuổi chưa thích ứng tạo đáp ứng miễn dịch với vắc xin ViPS.

Do những nhược điểm trên nên cần phải có giải pháp khắc phục. Các nghiên cứu đã chứng minh là nếu ViPS được gắn với một chất mang là protein, tạo một phức cộng hợp sẽ làm thay đổi kích thước phân tử của Vi và nhờ đó thay đổi cơ chế miễn dịch của vắc xin Thương hàn được pha chế từ phức cộng hợp Vi-Protein, tức cơ chế miễn dịch có sự tham gia của tế bào T nên tạo trí nhớ miễn dịch, vắc xin cộng hợp này thích hợp với đặc điểm cơ chế miễn dịch ở trẻ sơ sinh, do đó có thể sử dụng cho trẻ dưới 2 tuổi và tất cả các đối tượng thuộc mọi lứa tuổi khác nhau.
Công ty TNHH MTV Vắc xin Pasteur Đà Lạt (DAVAC) được Viện Sức khỏe Quốc gia Hoa Kỳ chuyển giao công nghệ sản xuất vắc xin THVi Polysaccharide từ năm 1995 và đã sản xuất thành công, được Bộ Y tế cấp phép lưu hành từ năm 2003, sau đó năm 2004 được Chương trình Tiêm chủng Mở rộng Quốc gia sử dụng. Đồng thời từ năm 2005 chính phủ Hàn Quốc đã cung cấp vốn ODA cho DAVAC xây dựng hoàn thiện dây chuyền sản xuất vắc xin THVi Polysaccharide, đạt tiêu chuẩn GMP theo WHO do Bộ Y tế cấp. Tiếp theo năm 2007, Cục dược Cuba (CECMED) cũng cấp chứng nhận GMP cho dây chuyền đóng ống tại nhà xưởng sản xuất vắc xin THVi polysaccharide của DAVAC.
Với tính ưu việt của VXTH Vi cộng hợp đã được chứng minh cả về lý thuyết lẫn thực tiễn ở nhiều nước, cùng với những điều kiện thuận lợi đã có của DAVAC, nhóm nghiên cứu gồm Cơ quan chủ trì là Bộ Khoa học và Công nghệ cùng phối hợp với Chủ nhiệm đề tài Th.S Đàm Thị Thu Ngân đặt vấn đề nghiên cứu xây dựng quy trình sản xuất vắc xin THVi cộng hợp nhằm các mục tiêu sau: Nghiên cứu quy trình sản xuất VXTH Vi cộng hợp quy mô Pilot (5.000 liều/lô) và sản xuất các lô VXTH Vi cộng hợp đạt chất lượng thử nghiệm tiền lâm sàng; Xây dựng tiêu chuẩn cơ sở và quy trình kiểm định VXTH Vi cộng hợp.
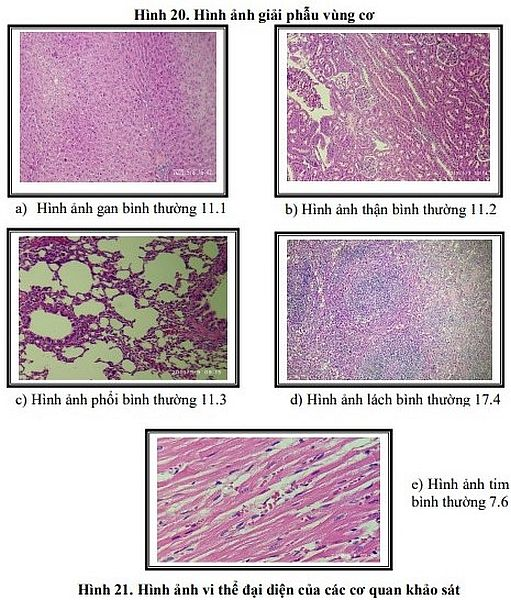
Sau thời gian nghiên cứu, đề tài đã nghiên cứu xây dựng thành công quy trình sản xuất vắc xin Thương hàn Vi cộng hợp từ KN ViPS của chủng Salmonella typhi Ty2 và protein mang là giải độc tố Uốn ván (TT) của chủng Clostridium tetani của Harvard No. 49205, coded Y dựa trên liên kết cộng hóa trị giữa 2 phân tử hữu cơ với chất làm cầu nối trung gian Hydrazine dihydrochloride (HH) quy mô 5000 liều/lô và sản xuất thành công 6 lô vắc xin Thương hàn Vi cộng hợp (3 lô đơn liều và 3 lô đa liều) đạt TCCS, thử nghiệm tiền lâm sàng trên ĐVTN đạt tính an toàn, có khả năng sinh miễn dịch và không độc tính.
Đã xây dựng được quy trình sản xuất VXTH Vi cộng hợp quy mô 5000 liều/lô theo GMP (Quy trình sản xuất tổng thể; Quy trình sản xuất cho các công đoạn sản xuất sản phẩm trung gian; Tiêu chuẩn cơ sở và phương pháp kiểm định cho VX thành phẩm; Tiêu chí kiểm soát chất lượng và phương pháp kiểm tra cho sác sản phẩm trung gian; Quy trình kiểm soát nhà xưởng, đào tạo, nhân sự, nguyên liệu, đóng gói, bảo quản, yêu cầu về thiết bị máy móc, dụng cụ…).
Có thể tìm đọc báo cáo kết quả nghiên cứu (mã số 16784/2019) tại Cục Thông tin KHCNQG.
Đ.T.V (NASATI)